人工智能医疗器械
随着人工智能技术的不断深入发展,赋能医疗器械升级优化成为融合趋势之一,人工智能医疗器械也就应运而生。2022年,为进一步规范人工智能医疗器械的管理,国家药监局器审中心制定《人工智能医疗器械注册审查指导原则》,清晰直观的介绍了人工智能医疗器械的注册申报,包括第二类、第三类人工智能独立软件和含有人工智能软件组件的医疗器械(包括体外诊断医疗器械)等。部分重点信息再次理解分享如下:
当前,人工智能技术广泛应用于医疗健康领域,相关的软件种类繁多。这些软件应用于患者端,可以提供各种健康记录、分析评估、测试、监测等功能;应用于医院端,可以提供数据管理、生命体征监测、辅助诊断治疗等功能。当软件满足一定条件则会落入医疗器械的管理范围,这时软件的开发者、生产者以及使用者需要按照监管的要求取得许可,并采取严格的管理措施。
人工智能医疗器械的体系定位
人工智能医疗器械属于数字医疗(Digital Health)体系,同时是医疗器械软件和医疗器械的下位概念,应当在符合医疗器械一般监管要求的基础上,遵守医疗器械软件和人工智能医疗器械的特殊规定。
文件中指出,人工智能医疗器械是指基于“医疗器械数据”,采用人工智能技术实现其预期用途(即医疗用途)的医疗器械。
更多介绍
医疗器械数据是指医疗器械产生的用于医疗用途的客观数据,如医学影像设备产生的医学图像数据(如X射线、CT、MRI、超声、内窥镜、光学等图像)、医用电子设备产生的生理参数数据(如心电、脑电、血压、无创血糖、心音等波形数据)、体外诊断设备产生的体外诊断数据(如病理图像、显微图像、有创血糖波形数据等);在特殊情形下,通用设备(非监管对象)产生的用于医疗用途的客观数据亦属于医疗器械数据,如数码相机拍摄的用于皮肤疾病诊断的皮肤照片、健康电子产品采集的用于心脏疾病预警的心电数据等。基于医疗器械数据包括医疗器械数据的生成、使用等情况,其中使用情况含单独使用医疗器械数据,或者以医疗器械数据为主联合使用非医疗器械数据(如患者主诉信息、检验检查报告结论、电子病历、医学文献等)。
医疗器械的认定根据相关法规,同时满足以下3个条件的软件,将会作为人工智能医疗器械管理:
1、处理医疗器械数据
医疗器械数据包括两类:一类是,各类医疗器械在使用中产生的客观数据,如医学影像、生理参数、体外诊断数据等。一类是,非医疗器械的设备产生的可用于医疗用途的数据,如智能可穿戴设备收集的健康数据。
2、使用人工智能技术
人工智能是指机器表现出与人类智能相关行为的能力。在医疗器械领域,人工智能主要指机器学习,机器学习中以深度学习为主流。其应用在医疗器械领域的核心功能主要是对医疗器械数据进行处理、测量、模型计算和分析。

(人工智能与机器学习、深度学习的关系)
3、用于医疗用途
医疗用途是指疾病的诊断、治疗,生理结构、生理过程的检查,以及提供相关的支持信息等用途。根据《医疗器械监督管理条例》,具体包括:(一)疾病的诊断、预防、监护、治疗或者缓解;(二)损伤的诊断、监护、治疗、缓解或者功能补偿;(三)生理结构或者生理过程的检验、替代、调节或者支持;(四)生命的支持或者维持;(五)妊娠控制;(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
那么不属于医疗器械软件的情形主要是哪些?
1、外部软件环境
医疗器械软件的运行需要依赖于完整的软件系统,包括平台软件、应用软件、中间件等。其中,医疗器械软件属于应用软件,是实现医疗用途的必备软件。平台软件是应用软件运行时所依赖的环境,中间件介于系统软件和应用案件之间。除必备软件外,其他提供运行支持的系统软件、通用应用软件、通用中间件、支持软件等属于外部软件环境。必备软件作为医疗器械单独注册,外部软件环境不属于医疗器械软件。
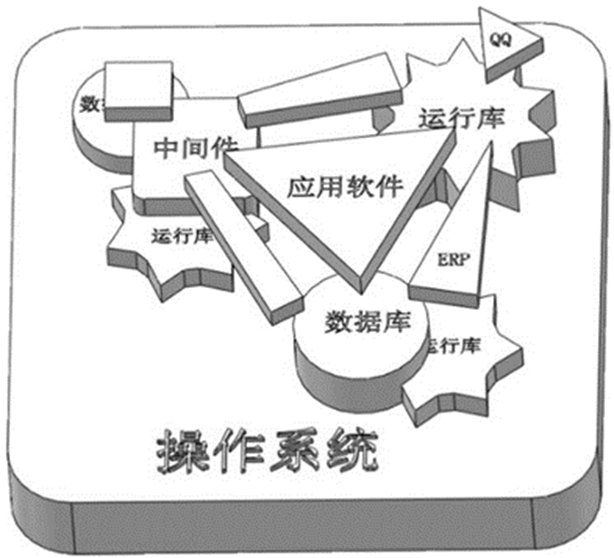
(应用软件、系统软件与中间件的关系)
2、质量管理软件
对医疗器械进行质量管理的应用软件,不属于医疗器械软件,无需申报注册。
值得注意的是,文件中专门强调:基于非医疗器械数据的医学人工智能产品,或者采用人工智能技术实现非医疗用途和非医疗器械功能(详见医疗器械软件指导原则)的医疗器械均非人工智能医疗器械。医学人工智能产品是否按医疗器械管理,根据相应分类界定指导原则进行判定,必要时申请医疗器械分类界定。
人工智能医疗器械类型
从医疗器械软件角度,人工智能医疗器械可分为人工智能独立软件和人工智能软件组件,故其类型划分可参考医疗器械软件指导原则相关维度。
从用途角度,人工智能医疗器械可分为辅助决策类和非辅助决策类。
辅助决策是指通过提供诊疗活动建议辅助用户(如医务人员、患者)进行医疗决策,如通过病灶特征识别、病灶性质判定、用药指导、治疗计划制定进行辅助分诊、辅助检测、辅助诊断、辅助治疗等,相当于用户的“助手”。反之,仅提供医疗参考信息而不进行医疗决策即为非辅助决策,包括流程优化、诊疗驱动,前者如成像流程简化、诊疗流程简化等,后者如成像质量改善、成像速度提高、自动测量、自动分割、三维重建等,相当于用户的“工具”。此外,辅助决策和非辅助决策从实时性角度均可细分为实时和非实时,前者风险通常高于后者。
从功能角度,人工智能医疗器械大体上可分为处理功能、控制功能、安全功能。
处理功能又可分为前处理功能和后处理功能,前处理功能是指采集人体解剖、生理信息生成医疗器械数据过程的处理功能,如成像流程简化、成像质量改善、成像速度提高等;后处理功能是指利用医疗器械数据生成诊疗信息或进行医疗干预过程的处理功能,如诊疗流程简化、自动测量、自动分割、三维重建、病灶特征识别、病灶性质判定、用药指导、治疗计划制定等。
控制功能是指控制/驱动医疗器械硬件运行的功能,如闭环控制、机械臂运动控制等。安全功能是指保证医疗器械安全性的功能,如风险预警、急停控制等。
从算法角度,人工智能医疗器械具有多种类型划分维度。
从学习策略角度可分为有监督学习和无监督学习,前者需要对训练数据进行标注,如线性回归、逻辑回归、决策树、朴素贝叶斯、K近邻、支持向量机等经典回归、分类算法,后者无需对训练数据进行标注,如K均值、主成分分析等经典聚类、降维算法,前者对于数据标注的要求高于后者。
从学习方法角度可分为基于模型的算法和基于数据的算法,前者采用统计模型、规则推理等方法,后者主要采用大数据方法,前者对于训练数据量的要求低于后者。从可解释性角度可分为白盒算法和黑盒算法,前者特征提取需要人为干预,可与现有医学知识建立关联,后者自动完成特征提取,难与现有医学知识建立关联,前者可解释性优于后者。
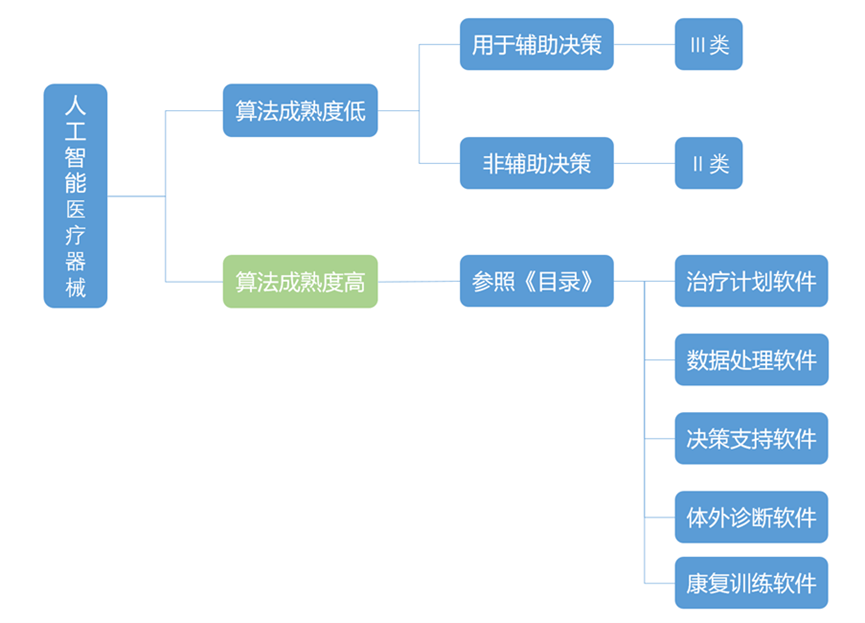
从成熟度角度,人工智能医疗器械可分为成熟和全新两种类型。
其中成熟是指安全有效性已在医疗实践中得到充分证实的情形,全新是指未上市或安全有效性尚未在医疗实践中得到充分证实的情形。人工智能医疗器械的算法、功能、用途若有一项为全新则属于全新类型,反之属于成熟类型。
根据《人工智能医用软件产品分类界定指导原则》,人工智能医疗器械的分类需结合产品的预期用途和算法成熟度综合考量。同时作为医疗器械的子集,其分类应符合《医疗器械分类管理目录》。结合二者,人工智能医疗器械的管理类别情况参考如下:
医疗器械注册申报
注册申报资料在符合医疗器械注册申报资料要求等文件要求基础上,满足医疗器械软件、医疗器械网络安全、移动医疗器械等相关指导原则要求。产品注册时要重点关注人工智能独立软件、人工智能软件组件、算法研究资料、用户培训方案、产品技术要求等。
